ESTRUCTURAS DE LEWIS
Como se adelantó en Enlace Químico y en Ácido-Base, Lewis determinó una forma para poder representar enlaces covalentes, basándose en los electrones de valencia de cada átomo.
Aquí se verán alrededor de 5 pasos sencillos para lograr una representación de Lewis de manera correcta:
Para ilustrar esto de buena manera, se colocarán dos ejemplos en donde, en el primero, se llega hasta el paso 4 y en el otro se llega al paso 5.
Ejemplo 1: Amoniaco
Anexo 1, Imagen 1: Paso 1
Aquí se verán alrededor de 5 pasos sencillos para lograr una representación de Lewis de manera correcta:
- Contar los electrones de valencia de todos los átomos involucrados. Este número es el total de electrones a representar.
- Dibujar el átomo central (o los átomos centrales) con sus electrones de valencia alrededor (representados por x o puntos).
- Dibujar el resto de los átomos alrededor del átomo central, haciendo coincidir un electrón de valencia de este último (del átomo central) con un electrón de valencia del átomo secundario.
- Contar el número de electrones alrededor de cada átomo. Los átomos H, Li y Be deben estar rodeados por dos electrones (correspondientes a los electrones del enlace) y los demás elementos deben estar rodeados por ocho electrones. Si se cumple el primer caso, entonces se dice que se cumple con la regla del dueto, y si se cumple el segundo caso, se dice que se cumple con la regla del octeto.* Si no se cumplen estas reglas, lea el 5to paso.
- Si no se cumplen las reglas anteriores (paso 4) entonces tiene que hacerlas calzar. Si le sobran electrones, rompa algunos enlaces y si le faltan forme nuevos enlaces hasta que se cumplan las reglas.
Para ilustrar esto de buena manera, se colocarán dos ejemplos en donde, en el primero, se llega hasta el paso 4 y en el otro se llega al paso 5.
Ejemplo 1: Amoniaco
Anexo 1, Imagen 1: Paso 1
Anexo 1, Imagen 2: Paso 2
Anexo 1, Imagen 3: Paso 3

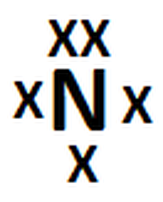
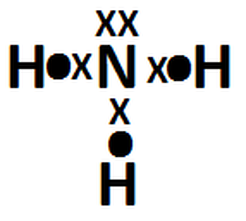
Excelente información
ResponderBorrarGracias por la información si me sirvió mucho
ResponderBorrarMe sirvió mucho tu información gracias
ResponderBorrargracias excelente info
ResponderBorrarBuena info
ResponderBorrar